종양괴사인자 알파
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
종양괴사인자 알파(TNF)는 1975년 Carswell 등이 발견한 물질로, 종양을 출혈 및 괴사시키는 물질을 분비하도록 대식세포를 유도한다. TNF는 1980년대에 정제 및 클론화되었으며, 항암 가능성이 연구되었으나 독성 문제로 인해 상용화되지 못했다. 이후 TNF가 염증성 질환에 관여한다는 사실이 밝혀지면서 TNF 억제제가 류마티스 관절염 치료에 사용되기 시작했다. TNF는 척추동물 진화 초기에 발달한 유전자에서 유래되었으며, 인간의 경우 6번 염색체에 위치한다. TNF는 선천 면역계의 주요 매개체로서 TNFR1과 TNFR2 수용체에 결합하여 세포 생존 또는 세포 사멸을 유도하며, 자가면역 질환, 암, 감염, 패혈증, 간 섬유화, 인슐린 저항성 등 다양한 질병의 병리에 관여한다.
더 읽어볼만한 페이지
- 면역 자극제 - 인터페론 감마
인터페론 감마는 바이러스, 세균, 원충 감염에 대항하는 면역에 중요한 역할을 하는 제2형 인터페론 사이토카인으로, 대식세포 활성화, 항바이러스, 면역조절, 항종양 활성 등 다양한 기능을 수행하며 육아종 형성, 임신 유지, 암 면역 치료에도 관여한다. - 면역 자극제 - 헤모시아닌
헤모시아닌은 연체동물과 절지동물의 혈액에서 산소 운반 역할을 하는 구리 함유 단백질이며, 헤모글로빈과 유사하게 산소를 운반하지만 분자 구조와 메커니즘에 차이가 있고, 촉매 활성 및 항암 효과에 대한 연구가 진행된다. - 사이토카인 - 인터루킨
인터루킨은 백혈구가 생성하여 면역 반응을 매개하는 사이토카인의 일종으로, 면역계 기능에 중요한 역할을 하며, 질병과 관련되어 면역요법 등에 활용된다. - 사이토카인 - 인터페론
인터페론은 바이러스 감염에 대한 세포 방어에 중요한 단백질로, 1형, 2형, 3형으로 나뉘어 면역 수용체에 따라 항바이러스, 항암 효과, 면역 체계 활성화 등의 다양한 작용을 하며, 유전자 조작을 통해 대량 생산되어 바이러스성 간염, 일부 종양 및 백혈병 치료에 활용된다. - 인간 6번 염색체상 유전자 - 뮤신 21
뮤신 21은 대한민국의 웹사이트 또는 온라인 커뮤니티로 추정되지만, 구체적인 정보가 부족하여 성격과 활동 내용을 파악하기 어려운 상황이다. - 인간 6번 염색체상 유전자 - 에스트로겐 수용체
에스트로겐 수용체는 세포 내에서 에스트로겐과 결합하여 유전자 발현을 조절하는 단백질로, ERα와 ERβ의 두 가지 주요 아이소폼이 존재하며, 유방암, 폐경, 비만 등 다양한 질병과 관련되어 선택적 에스트로겐 수용체 조절제의 표적이 되고 비유전체적 신호 전달 경로에도 관여한다.
2. 역사
1890년대에 윌리엄 콜리는 급성 감염이 종양의 퇴행을 유발할 수 있다는 것을 관찰하여 세균 독소를 암 치료에 사용하게 되었다.[17] 1944년, 내독소는 콜리의 세균 독소에서 항암 효과를 나타내는 물질로 분리되었으며, 특히 내독소는 실험적으로 유도된 암을 가진 생쥐에게 주사했을 때 종양 퇴행을 유발할 수 있었다.[17] 1975년, Carswell 등은 내독소가 직접적으로 종양 퇴행을 유발하는 것이 아니라, 대신 대식세포가 종양을 출혈 및 괴사시키는 물질을 분비하도록 유도한다는 것을 발견했으며, 이를 "종양 괴사 인자"라고 명명했다.[17]
1980년대에 TNF는 정제, 염기 서열 분석 및 세균 내에서 클론화되었다.[17] 재조합 TNF에 대한 연구는 TNF의 항암 가능성을 확인했지만, TNF 주사가 내독소 쇼크를 유발한다는 사실이 밝혀지면서 낙관론은 사라졌다.[17] TNF는 또한 생쥐에서 근육 소모를 유발하는 것으로 알려진 캐켁틴과 동일한 단백질임이 밝혀졌다.[17] 이러한 발견은 TNF가 과도한 양으로 존재할 경우 해로울 수 있음을 보여주었다. 1992년, TNF 항체가 생쥐의 관절 염증을 감소시키는 것으로 밝혀지면서, TNF가 염증성 질환에 관여한다는 사실이 드러났다.[17] 이는 1998년 항-TNF 치료제가 류마티스 관절염에 대해 처음으로 승인되는 결과를 낳았다.[17]
2. 1. 초기 발견
1890년대에 윌리엄 콜리는 급성 감염이 종양의 퇴행을 유발할 수 있다는 것을 관찰하여 세균 독소를 암 치료에 사용하게 되었다.[17] 1944년, 내독소는 콜리의 세균 독소에서 항암 효과를 나타내는 물질로 분리되었으며, 실험적으로 유도된 암을 가진 생쥐에게 주사했을 때 종양 퇴행을 유발할 수 있었다.[17] 1975년, Carswell 등은 내독소가 직접적으로 종양 퇴행을 유발하는 것이 아니라, 대신 대식세포가 종양을 출혈 및 괴사시키는 물질을 분비하도록 유도한다는 것을 발견했으며, 이를 "종양 괴사 인자"라고 명명했다.[17]2. 2. 정제, 클로닝 및 초기 연구
1890년대에 윌리엄 콜리는 급성 감염이 종양의 퇴행을 유발할 수 있다는 것을 관찰하여 세균 독소를 암 치료에 사용하게 되었다.[17] 1944년, 내독소는 콜리의 세균 독소에서 항암 효과를 나타내는 물질로 분리되었으며, 특히 내독소는 실험적으로 유도된 암을 가진 생쥐에게 주사했을 때 종양 퇴행을 유발할 수 있었다.[17] 1975년, Carswell 등은 내독소가 직접적으로 종양 퇴행을 유발하는 것이 아니라, 대신 대식세포가 종양을 출혈 및 괴사시키는 물질을 분비하도록 유도한다는 것을 발견했으며, 이를 "종양 괴사 인자"라고 명명했다.[17]1980년대에 TNF는 정제, 염기 서열 분석 및 세균 내에서 클론화되었다.[17] 재조합 TNF에 대한 연구는 TNF의 항암 가능성을 확인했지만, TNF 주사가 내독소 쇼크를 유발한다는 사실이 밝혀지면서 낙관론은 사라졌다.[17] TNF는 또한 생쥐에서 근육 소모를 유발하는 것으로 알려진 캐켁틴과 동일한 단백질임이 밝혀졌다.[17] 이러한 발견은 TNF가 과도한 양으로 존재할 경우 해로울 수 있음을 보여주었다. 1992년, TNF 항체가 생쥐의 관절 염증을 감소시키는 것으로 밝혀지면서, TNF가 염증성 질환에 관여한다는 사실이 드러났다.[17] 이는 1998년 항-TNF 치료제가 류마티스 관절염에 대해 처음으로 승인되는 결과를 낳았다.[17]
2. 3. TNF 억제제 개발
1992년, TNF 항체가 생쥐의 관절 염증을 감소시키는 것으로 밝혀지면서, TNF가 염증성 질환에 관여한다는 사실이 드러났다.[17] 이는 1998년 항-TNF 치료제가 류마티스 관절염에 대해 처음으로 승인되는 결과를 낳았다.[17]2. 4. 명칭 변화
1985년에 종양 괴사 인자(TNF)는 이전에 발견된 림프독소라는 사이토카인과 상당한 서열 및 기능적 유사성을 갖는 것으로 밝혀졌다.[43] 이로 인해 TNF는 TNF-α로, 림프독소는 TNF-β로 이름이 변경되었다.[43] 그러나 1993년에는 림프독소와 매우 유사한 단백질이 발견되어 림프독소-β로 명명되었다.[43] 1998년 제7회 국제 TNF 학회에서 TNF-β는 공식적으로 림프독소-α로, TNF-α는 다시 TNF로 이름이 변경되었다.[43] 그럼에도 불구하고 일부 논문에서는 TNF-α라는 용어를 계속 사용하고 있다.[43]3. 진화
종양괴사인자(TNF)와 림포톡신-α 유전자는 무악류와 턱구류의 분화 이전에 척추동물 진화 초기에 발달한 공통 조상 유전자에서 유래된 것으로 여겨진다.[4] 이 조상 유전자는 무악류 조상에서는 사라졌지만, 턱구류 조상에서는 지속되었다. 턱구류의 진화 과정에서 이 조상 유전자는 TNF 유전자와 림포톡신-α 유전자로 중복되었다.[4] 따라서, 조상 유전자는 다양한 턱구류 종에서 발견되지만, TNF 유전자를 포함하는 턱구류 종은 일부에 불과하다. 제브라피쉬(Danio)와 같은 일부 어류 종에서 TNF 유전자의 중복본이 발견되었다.[4]
TNF 유전자는 포유류 사이에서 매우 유사하며, 233개에서 235개의 아미노산으로 구성된다.[5] TNF 근위 프로모터 영역 또한 포유류 사이에서 매우 보존되어 있으며, 고등 영장류 사이에서는 거의 동일하다.[7] 어류 사이의 TNF 유전자 유사성은 낮으며, 226개에서 256개의 아미노산으로 구성된다. 포유류 TNF와 마찬가지로, 어류 TNF 유전자는 대식세포에서 항원에 의해 자극되는 것으로 나타났다.[5] 모든 TNF 유전자는 TNF를 수용체에 결합시키는 중요한 역할 때문에 TNF 상동성 도메인으로 알려진 고도로 보존된 C-말단 모듈을 가지고 있다.[4]
3. 1. 척추동물 진화 초기 기원
종양괴사인자(TNF)와 림포톡신-α 유전자는 무악류와 턱구류의 분화 이전에 척추동물 진화 초기에 발달한 공통 조상 유전자에서 유래된 것으로 여겨진다.[4] 이 조상 유전자는 무악류 조상에서는 사라졌지만, 턱구류 조상에서는 지속되었다. 턱구류의 진화 과정에서 이 조상 유전자는 TNF 유전자와 림포톡신-α 유전자로 중복되었다.[4] 따라서, 조상 유전자는 다양한 턱구류 종에서 발견되지만, TNF 유전자를 포함하는 턱구류 종은 일부에 불과하다. 제브라피쉬(Danio)와 같은 일부 어류 종에서 TNF 유전자의 중복본이 발견되었다.[4]TNF 유전자는 포유류 사이에서 매우 유사하며, 233개에서 235개의 아미노산으로 구성된다.[5] TNF 근위 프로모터 영역 또한 포유류 사이에서 매우 보존되어 있으며, 고등 영장류 사이에서는 거의 동일하다.[7] 어류 사이의 TNF 유전자 유사성은 낮으며, 226개에서 256개의 아미노산으로 구성된다. 포유류 TNF와 마찬가지로, 어류 TNF 유전자는 대식세포에서 항원에 의해 자극되는 것으로 나타났다.[5] 모든 TNF 유전자는 TNF를 수용체에 결합시키는 중요한 역할 때문에 TNF 상동성 도메인으로 알려진 고도로 보존된 C-말단 모듈을 가지고 있다.[4]
3. 2. 턱구류 진화 과정
무악류와 턱구류의 분화 이전에 척추동물 진화 초기에 발달한 공통 조상 유전자에서 종양괴사인자(TNF)와 림포톡신-α 유전자가 유래된 것으로 여겨진다.[4] 이 조상 유전자는 무악류 조상에서는 사라졌지만, 턱구류 조상에서는 지속되었다. 턱구류의 진화 과정에서 이 조상 유전자는 TNF 유전자와 림포톡신-α 유전자로 중복되었다.[4] 따라서, 조상 유전자는 다양한 턱구류 종에서 발견되지만, TNF 유전자를 포함하는 턱구류 종은 일부에 불과하다. 제브라피쉬(Danio)와 같은 일부 어류 종에서 TNF 유전자의 중복본이 발견되었다.[4]TNF 유전자는 포유류 사이에서 매우 유사하며, 233개에서 235개의 아미노산으로 구성된다.[5] TNF 근위 프로모터 영역 또한 포유류 사이에서 매우 보존되어 있으며, 고등 영장류 사이에서는 거의 동일하다.[7] 어류 사이의 TNF 유전자 유사성은 낮으며, 226개에서 256개의 아미노산으로 구성된다. 포유류 TNF와 마찬가지로, 어류 TNF 유전자는 대식세포에서 항원에 의해 자극되는 것으로 나타났다.[5] 모든 TNF 유전자는 TNF를 수용체에 결합시키는 중요한 역할 때문에 TNF 상동성 도메인으로 알려진 고도로 보존된 C-말단 모듈을 가지고 있다.[4]
3. 3. 포유류 및 어류에서의 TNF 유전자
종양괴사인자(TNF)와 림포톡신-α 유전자는 무악류와 턱구류의 분화 이전에 척추동물 진화 초기에 발달한 공통 조상 유전자에서 유래된 것으로 여겨진다. 이 조상 유전자는 무악류 조상에서는 사라졌지만, 턱구류 조상에서는 지속되었다. 턱구류의 진화 과정에서 이 조상 유전자는 TNF 유전자와 림포톡신-α 유전자로 중복되었다.[4] 따라서, 조상 유전자는 다양한 턱구류 종에서 발견되지만, TNF 유전자를 포함하는 턱구류 종은 일부에 불과하다. 제브라피쉬(Danio)와 같은 일부 어류 종에서 TNF 유전자의 중복본이 발견되었다.[4]TNF 유전자는 포유류 사이에서 매우 유사하며, 233개에서 235개의 아미노산으로 구성된다.[5] TNF 근위 프로모터 영역 또한 포유류 사이에서 매우 보존되어 있으며, 고등 영장류 사이에서는 거의 동일하다.[7] 어류 사이의 TNF 유전자 유사성은 낮으며, 226개에서 256개의 아미노산으로 구성된다. 포유류 TNF와 마찬가지로, 어류 TNF 유전자는 대식세포에서 항원에 의해 자극되는 것으로 나타났다.[5] 모든 TNF 유전자는 TNF를 수용체에 결합시키는 중요한 역할 때문에 TNF 상동성 도메인으로 알려진 고도로 보존된 C-말단 모듈을 가지고 있다.[4]
4. 유전자
인간 TNF 유전자는 6번 염색체 p21.3에 위치하며, 많은 면역계 유전자가 포함된 주요 조직 적합성 복합체의 class III 영역에 존재한다.[6] class III 영역은 중심체 측면에 있는 HLA-DR 유전자좌와 텔로미어 측면에 있는 HLA-B 유전자좌 사이에 위치한다.[6] TNF 유전자는 HLA-B 유전자좌로부터 250킬로베이스 떨어져 있으며, HLA-DR 유전자좌로부터 850킬로베이스 떨어져 있다.[6] TNF 유전자는 림프독소-α 유전자로부터 1,100킬로베이스 하류에 위치한다.[6]
TNF는 여러 세포 유형에 의해 많은 자극에 반응하여 빠르게 생성된다. TNF를 발현하는 세포 유형에는 T 세포, B 세포, 대식세포, 비만 세포, 수지상 세포, 섬유아세포가 있으며, TNF 유전자를 활성화하는 자극에는 병원성 물질, 다른 면역 세포의 사이토카인, 환경 스트레스 요인이 있다. 이러한 사이토카인에는 인터루킨-1, 인터루킨-2, 인터페론-γ, TNF 자체가 포함된다. TNF 전사는 세포 유형과 자극에 따라 다양한 신호 전달 경로와 전사 인자에 의해 활성화된다. TNF 전사는 새로운 단백질의 합성에 의존하지 않아 유전자를 빠르게 활성화할 수 있다.[7]
TNF 유전자 발현은 약 200개의 염기쌍으로 구성된 근위 프로모터 영역에 의해 조절된다. 근위 프로모터 영역 내의 대부분의 결합 부위는 여러 전사 인자를 인식할 수 있어 TNF가 다양한 신호 전달 경로에 의해 활성화될 수 있다. 전사 인자가 프로모터 영역에 결합하면 공동 활성 인자에도 결합하여 강화소체라고 하는 큰 구조로 조립된다. 강화소체의 구성은 세포 내 주변 요인, 특히 활성화된 T 세포의 핵 인자 (NFAT)에 따라 달라진다.[7]
TNF 발현은 또한 DNA 구조에 의해 조절된다. DNA는 히스톤 주위에 감겨 있으며, 이는 히스톤 아세틸화 및 탈아세틸화에 의해 풀리고 히스톤 메틸화에 의해 응축된다. TNF 프로모터에서 히스톤을 아세틸화하는 단백질, 특히 T 세포의 CREB-결합 단백질은 TNF 발현에 종종 중요하다. 반대로 TNF를 발현하지 않는 여러 세포 유형은 TNF 프로모터의 히스톤에서 고도로 메틸화된다. 장거리 내염색체 상호 작용도 TNF 발현을 조절할 수 있다. 활성화된 T 세포에서 TNF 프로모터를 둘러싼 DNA가 원형화되어 프로모터 복합체를 더 가깝게 가져오고 전사 효율을 향상시킨다.[7]
사람 종양괴사인자 알파(TNF) 유전자의 전사된 영역은 3개의 인트론으로 분리된 4개의 엑손을 포함한다.[8] 1차 전사체는 2,762개의 염기쌍을, mRNA는 1,669개의 염기쌍을 포함한다.[9]
mRNA는 5' 비번역 영역, 막관통 부분, 가용성 부분, 3' 비번역 영역의 4개 영역으로 구성된다.[10] 가용성 부분의 80% 이상은 마지막 엑손에 포함되어 있으며, 막관통 부분은 처음 두 개의 엑손에 포함되어 있다.[10] 3' 비번역 영역은 ARE를 포함하여 TNF의 번역을 조절한다.[10] 자극받지 않은 대식세포에서 다양한 단백질이 ARE에 결합하여 TNF mRNA를 불안정하게 만들고 번역을 억제한다.[11] 그러나 대식세포가 활성화되면 TNF 번역 억제가 해제된다.[11]
4. 1. 유전자 위치
인간 TNF 유전자는 6번 염색체 p21.3에 위치하며, 많은 면역계 유전자가 포함된 주요 조직 적합성 복합체의 class III 영역에 존재한다.[6] class III 영역은 중심체 측면에 있는 HLA-DR 유전자좌와 텔로미어 측면에 있는 HLA-B 유전자좌 사이에 위치한다.[6] TNF 유전자는 HLA-B 유전자좌로부터 250킬로베이스 떨어져 있으며, HLA-DR 유전자좌로부터 850킬로베이스 떨어져 있다.[6] TNF 유전자는 림프독소-α 유전자로부터 1,100킬로베이스 하류에 위치한다.[6]4. 2. 유전자 발현
TNF는 여러 세포 유형에 의해 많은 자극에 반응하여 빠르게 생성된다. TNF를 발현하는 세포 유형에는 T 세포, B 세포, 대식세포, 비만 세포, 수지상 세포, 섬유아세포가 있으며, TNF 유전자를 활성화하는 자극에는 병원성 물질, 다른 면역 세포의 사이토카인, 환경 스트레스 요인이 있다. 이러한 사이토카인에는 인터루킨-1, 인터루킨-2, 인터페론-γ, TNF 자체가 포함된다. TNF 전사는 세포 유형과 자극에 따라 다양한 신호 전달 경로와 전사 인자에 의해 활성화된다. TNF 전사는 새로운 단백질의 합성에 의존하지 않아 유전자를 빠르게 활성화할 수 있다.[7]
TNF 유전자 발현은 약 200개의 염기쌍으로 구성된 근위 프로모터 영역에 의해 조절된다. 근위 프로모터 영역 내의 대부분의 결합 부위는 여러 전사 인자를 인식할 수 있어 TNF가 다양한 신호 전달 경로에 의해 활성화될 수 있다. 전사 인자가 프로모터 영역에 결합하면 공동 활성 인자에도 결합하여 강화소체라고 하는 큰 구조로 조립된다. 강화소체의 구성은 세포 내 주변 요인, 특히 활성화된 T 세포의 핵 인자 (NFAT)에 따라 달라진다.[7]
TNF 발현은 또한 DNA 구조에 의해 조절된다. DNA는 히스톤 주위에 감겨 있으며, 이는 히스톤 아세틸화 및 탈아세틸화에 의해 풀리고 히스톤 메틸화에 의해 응축된다. TNF 프로모터에서 히스톤을 아세틸화하는 단백질, 특히 T 세포의 CREB-결합 단백질은 TNF 발현에 종종 중요하다. 반대로 TNF를 발현하지 않는 여러 세포 유형은 TNF 프로모터의 히스톤에서 고도로 메틸화된다. 장거리 내염색체 상호 작용도 TNF 발현을 조절할 수 있다. 활성화된 T 세포에서 TNF 프로모터를 둘러싼 DNA가 원형화되어 프로모터 복합체를 더 가깝게 가져오고 전사 효율을 향상시킨다.[7]
4. 2. 1. 발현 조절 기전
TNF 유전자 발현은 약 200개의 염기쌍으로 구성된 근위 프로모터 영역에 의해 조절된다. 근위 프로모터 영역 내의 대부분의 결합 부위는 여러 전사 인자를 인식할 수 있어 TNF가 다양한 신호 전달 경로에 의해 활성화될 수 있다. 전사 인자가 프로모터 영역에 결합하면 공동 활성 인자에도 결합하여 강화소체라고 하는 큰 구조로 조립된다. 강화소체의 구성은 세포 내 주변 요인, 특히 활성화된 T 세포의 핵 인자 (NFAT)에 따라 달라진다.[7]
TNF 발현은 또한 DNA 구조에 의해 조절된다. DNA는 히스톤 주위에 감겨 있으며, 이는 히스톤 아세틸화 및 탈아세틸화에 의해 풀리고 히스톤 메틸화에 의해 응축된다. TNF 프로모터에서 히스톤을 아세틸화하는 단백질, 특히 T 세포의 CREB-결합 단백질은 TNF 발현에 종종 중요하다. 반대로 TNF를 발현하지 않는 여러 세포 유형은 TNF 프로모터의 히스톤에서 고도로 메틸화된다. 장거리 내염색체 상호 작용도 TNF 발현을 조절할 수 있다. 활성화된 T 세포에서 TNF 프로모터를 둘러싼 DNA가 원형화되어 프로모터 복합체를 더 가깝게 가져오고 전사 효율을 향상시킨다.[7]
4. 3. 전사
사람 종양괴사인자 알파(TNF) 유전자의 전사된 영역은 3개의 인트론으로 분리된 4개의 엑손을 포함한다.[8] 1차 전사체는 2,762개의 염기쌍을, mRNA는 1,669개의 염기쌍을 포함한다.[9]mRNA는 5' 비번역 영역, 막관통 부분, 가용성 부분, 3' 비번역 영역의 4개 영역으로 구성된다.[10] 가용성 부분의 80% 이상은 마지막 엑손에 포함되어 있으며, 막관통 부분은 처음 두 개의 엑손에 포함되어 있다.[10] 3' 비번역 영역은 ARE를 포함하여 TNF의 번역을 조절한다.[10] 자극받지 않은 대식세포에서 다양한 단백질이 ARE에 결합하여 TNF mRNA를 불안정하게 만들고 번역을 억제한다.[11] 그러나 대식세포가 활성화되면 TNF 번역 억제가 해제된다.[11]
5. 단백질
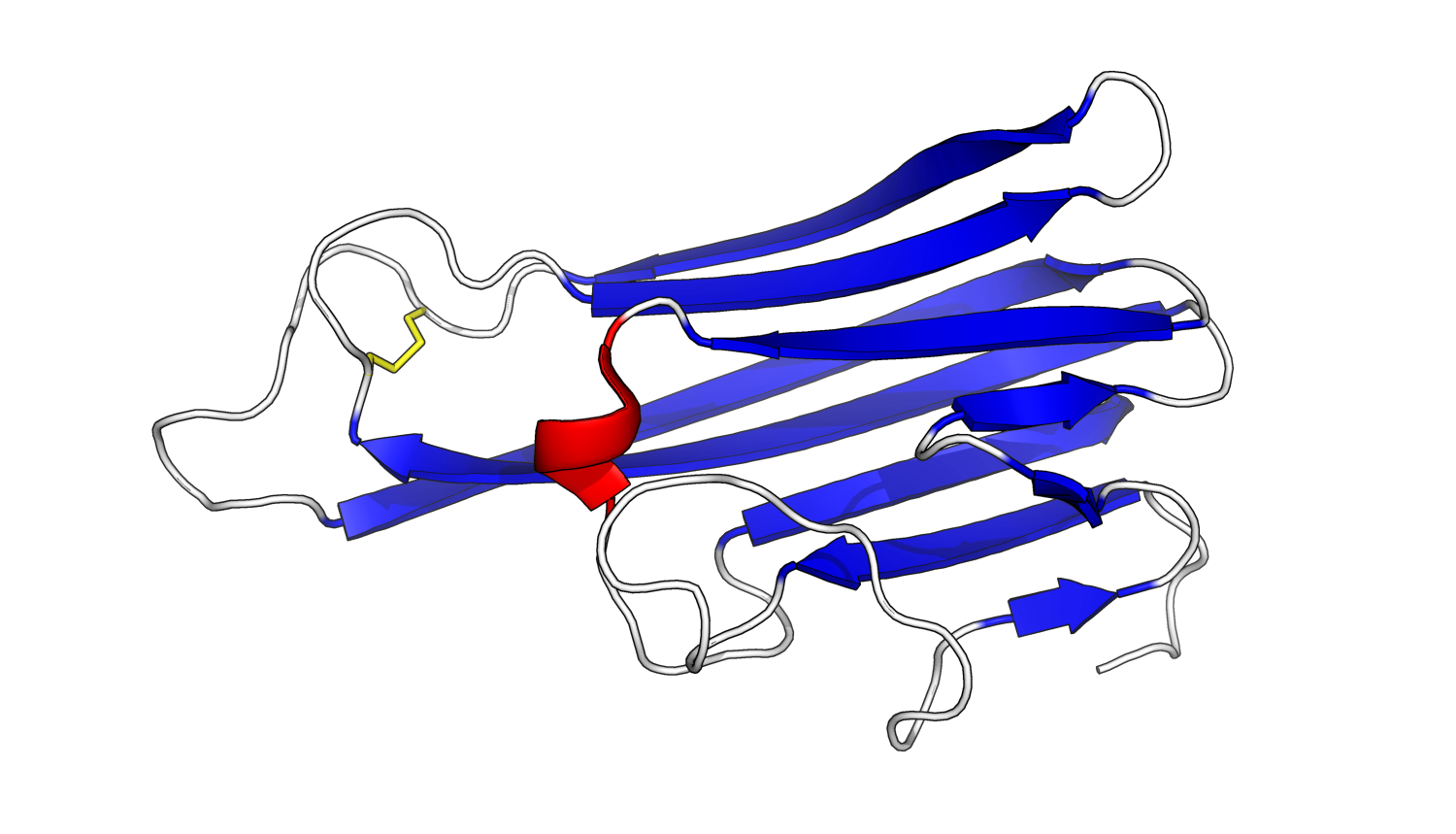
TNF는 처음에 233개 아미노산으로 구성된 막관통 단백질(tmTNF)로 생성된다.[12] tmTNF는 TNFR1과 TNFR2 모두에 결합하지만, 그 활성은 주로 TNFR2에 의해 매개된다.[12] 수용체에 결합하면 tmTNF는 자체 세포 내 신호 전달 경로도 활성화시킨다.[12] tmTNF는 TNF 알파 변환 효소(TACE)에 의해 절단되어 세포 외 부분이 분비된다.[12] 절단 후, 남은 tmTNF는 SPPL2B에 의해 다시 절단되어 세포 내 부분이 핵으로 이동한다.[12] 거기서 인터루킨-12의 발현을 유발하는 것과 같이 사이토카인 생성을 조절하는 것으로 여겨진다.[12]
분비된 세포 외 부분(sTNF)은 157개의 아미노산으로 구성되어 있다.[13] tmTNF와 달리 sTNF는 TNFR1에만 결합할 수 있다.[12] sTNF의 이차 구조는 주로 교대로 배열된 가닥으로 구성되며, 이 가닥들은 두 개의 시트를 형성하여, 이를 역평행 β-시트라고 한다. 두 시트는 서로 위에 겹쳐져 역평행 β-샌드위치로 알려진 쐐기 모양을 형성한다. 놀랍게도 이 구조는 바이러스 외피에서 보이는 구조와 유사하다. C-말단의 마지막 9개의 잔기는 하단 시트의 중간 가닥에 고정되어 있으며, 생물학적 활성에 필수적이다.[13]
tmTNF와 sTNF 모두 호모삼합체로만 생물학적 활성을 나타내며, 개별 단량체는 비활성 상태이다.[12] TNF 삼량체가 분해되는 속도는 일정하며, TNF 삼량체가 조립되는 속도는 TNF 농도에 따라 증가한다. 이로 인해 고농도에서는 TNF가 주로 삼량체 형태를 띠고, 저농도에서는 주로 단량체 및 이량체 형태를 띤다.[14] TNF 이량체와 삼량체가 동적 평형 상태로 공존하는 것은 TNF가 모르페인일 수 있음을 시사한다.[15] TNF 이량체를 안정화시키고 TNF 삼량체의 조립을 방지하는 작은 분자는 TNF 억제에 대한 잠재적인 메커니즘을 제시한다.[16]
5. 1. 막관통 TNF (tmTNF)
TNF는 처음에 233개 아미노산으로 구성된 막관통 단백질(tmTNF)로 생성된다.[12] tmTNF는 TNFR1과 TNFR2 모두에 결합하지만, 그 활성은 주로 TNFR2에 의해 매개된다.[12] 수용체에 결합하면 tmTNF는 자체 세포 내 신호 전달 경로도 활성화시킨다.[12] tmTNF는 TNF 알파 변환 효소 (TACE)에 의해 절단되어 세포 외 부분이 분비된다.[12] 절단 후, 남은 tmTNF는 SPPL2B에 의해 다시 절단되어 세포 내 부분이 핵으로 이동한다.[12] 거기서 인터루킨-12의 발현을 유발하는 것과 같이 사이토카인 생성을 조절하는 것으로 여겨진다.[12]5. 2. 분비형 TNF (sTNF)
분비된 세포 외 부분(sTNF)은 157개의 아미노산으로 구성되어 있다.[13] 막관통 단백질(tmTNF)와 달리 sTNF는 TNFR1에만 결합할 수 있다.[12] sTNF의 이차 구조는 주로 교대로 배열된 가닥으로 구성되며, 이 가닥들은 두 개의 시트를 형성하여, 이를 역평행 β-시트라고 한다. 두 시트는 서로 위에 겹쳐져 역평행 β-샌드위치로 알려진 쐐기 모양을 형성한다. 놀랍게도 이 구조는 바이러스 외피에서 보이는 구조와 유사하다. C-말단의 마지막 9개의 잔기는 하단 시트의 중간 가닥에 고정되어 있으며, 생물학적 활성에 필수적이다.[13]5. 3. 삼량체 형성
종양괴사인자 알파(TNF)는 처음에 233개의 아미노산으로 구성된 막관통 단백질(tmTNF)로 생성된다.[12] tmTNF는 TNF 알파 변환 효소 (TACE)에 의해 절단되어 세포 외 부분이 분비된다(sTNF).[12] sTNF의 이차 구조는 주로 교대로 배열된 가닥으로 구성되며, 이 가닥들은 두 개의 시트를 형성하여 역평행 β-시트를 이룬다. 두 시트는 서로 위에 겹쳐져 역평행 β-샌드위치로 알려진 쐐기 모양을 형성하는데, 이는 바이러스 외피에서 보이는 구조와 유사하다.[13]
tmTNF와 sTNF 모두 호모삼합체로만 생물학적 활성을 나타내며, 개별 단량체는 비활성 상태이다.[12] TNF 삼량체가 분해되는 속도는 일정하며, TNF 삼량체가 조립되는 속도는 TNF 농도에 따라 증가한다. 이로 인해 고농도에서는 TNF가 주로 삼량체 형태를 띠고, 저농도에서는 주로 단량체 및 이량체 형태를 띤다.[14] TNF 이량체와 삼량체가 동적 평형 상태로 공존하는 것은 TNF가 모르페인일 수 있음을 시사한다.[15] TNF 이량체를 안정화시키고 TNF 삼량체의 조립을 방지하는 작은 분자는 TNF 억제에 대한 잠재적인 메커니즘을 제시한다.[16]
6. 기능
종양괴사인자 알파(TNF)는 선천 면역계의 주요 매개체이다.[20] TNF는 수용체 TNFR1 및 TNFR2에 결합하여 표적 세포에서 세포 생존 또는 세포 사멸을 유도할 수 있다. 세포 생존 반응에는 세포 증식 및 염증 신호의 활성화가 포함되며, 세포 사멸 반응은 세포의 제어된 죽음인 세포 자멸사 또는 덜 제어되어 염증을 유발하고 주변 조직을 간섭하는 괴사성 세포사멸일 수 있다. TNF는 기본적으로 세포 생존을 유도하지만, 병원체의 염증 경로 파괴, 다른 사이토카인과의 공동 자극, TNFR1과 TNFR2 간의 상호 작용과 같은 요인에 의해 세포 사멸이 유도될 수 있다.[17] 또한, 막횡단 TNF(tmTNF)는 역 신호 전달체 역할을 하여 세포 유형 및 자극제에 따라 자체 세포에서 다양한 반응을 유발한다.[18]
'''TNFR1 신호 전달'''
TNFR1은 대부분의 세포 유형에 존재하며 tmTNF와 sTNF에 모두 결합한다. TNFR1은 세포질 꼬리에 사멸 도메인을 포함하고 있어 세포 사멸을 유발할 수 있다.[18] TNFR1 활성화가 세포 생존 또는 세포 사멸을 유발하는지 여부는 단백질 복합체의 형성에 의해 매개된다. 세포 생존으로 이어지는 복합체 I과 세포 사멸로 이어지는 복합체 II가 그것이다. 기본적으로 TNFR1 활성화는 세포 사멸보다는 세포 증식과 염증을 유발한다.
'''복합체 Ⅰ (세포 생존)'''
TNF에 의해 활성화되면 TNFR1은 삼량체화되어 RIPK1과 TRADD를 모집하여 복합체 Ⅰ을 형성하고, 이들은 다시 TRAF2, cIAP1 및 cIAP2, LUBAC를 모집한다. cIAP1과 cIAP2는 K63-연결된 유비퀴틴 사슬을 형성하는 유비퀴틴 연결 효소이며, 이는 TAB2 및 TAB3를 통해 TAK1을 모집한다. LUBAC 또한 M1-연결된 유비퀴틴 사슬을 형성하는 유비퀴틴 연결 효소이며, 이는 NEMO를 통해 IKK를 유인한다. TAK1은 MAPK 경로뿐만 아니라 IKK를 활성화하며, IKK는 다시 전형적인 NF-κB 경로를 활성화한다. MAPK 경로와 NF-κB 경로는 핵 내 여러 전사 인자를 활성화하여 세포 생존, 증식 및 염증 반응을 유발한다. 복합체 Ⅰ은 A20, CYLD, OTULIN과 같은 탈유비퀴틴화 효소에 의해 음성적으로 조절되며, 이는 복합체 Ⅰ을 불안정하게 만든다.[17]
'''복합체 Ⅱ (세포 사멸)'''
RIPK1 및/또는 TRADD가 복합체 Ⅰ에서 분리되어 FADD와 결합하여 카스파제 8을 활성화하면 복합체 Ⅱ가 형성되어 세포 사멸로 이어진다.[17] 복합체 Ⅱa는 TRADD를 포함하며 RIPK1 없이 카스파제 8을 활성화할 수 있는 반면, 복합체 Ⅱb는 TRADD를 포함하지 않으므로 카스파제 8의 활성화에 RIPK1에 의존한다. 복합체 Ⅰ의 경로는 복합체 Ⅱ가 세포 사멸을 유발하는 것을 방지하는 세 개의 검문 지점을 유도한다.[17]
'''세포 사멸 검문 지점'''
TNFR1 활성화는 세포 증식과 염증을 유발하며, 이러한 염증 경로는 세 개의 세포 사멸 검문 지점을 포함한다.[17] 각 검문 지점은 세포 사멸을 방지하는 데 중요한 역할을 한다.
- 첫 번째 검문 지점에서 IKK는 인산화를 통해 RIPK1을 비활성화한다. 이는 RIPK1에 의존하는 복합체 Ⅱb를 비활성화한다.[17] IKK는 복합체 Ⅰ의 유비퀴틴화에 의존하므로, cIAP1/2 및 LUBAC의 억제, RIPK1 유비퀴틴 수용체 부위의 돌연변이, A20 및 OUTLIN의 결핍과 같은 유비퀴틴화에 영향을 미치는 조건은 이 검문 지점을 비활성화할 수 있다.[17] IKK 검문 지점의 비활성화는 복합체 Ⅱb를 활성화하여 아폽토시스 또는 파이롭토시스를 유발하며, NF-κB 경로를 제어하는 두 번째 검문 지점을 비활성화하여 복합체 Ⅱa를 간접적으로 활성화할 수도 있다.[17]
- 두 번째 검문 지점에서 NF-κB 경로는 복합체 Ⅱa에서 카스파제 8의 활성을 억제하는 FLIP과 같은 생존 촉진 유전자의 발현을 촉진한다.[17] 이 검문 지점은 시클로헥시미드와 같은 번역 억제제뿐만 아니라 NF-κB 경로를 제어하는 IKK 복합체의 비활성화에 의해 비활성화될 수 있다.[17] 이 검문 지점의 비활성화는 복합체 Ⅱa를 활성화하여 아폽토시스를 유발한다.[17]
- 세 번째 검문 지점에서는 비치명적인 카스파제 8이 TNFR1 신호 전달에 의해 활성화되어 복합체 Ⅱb에 결합하여 RIPK1을 절단하여 비활성화한다.[17] 이 형태의 카스파제 8이 세포 사멸을 일으키지 않는 이유는 알려져 있지 않다.[17] 카스파제 8의 비활성화를 통해 이 검문 지점을 비활성화하면 복합체 Ⅱb의 RIPK1이 RIPK3 및 MLKL에 결합하여 복합체 Ⅱc를 형성하며, 이는 네크로솜이라고도 한다.[17] 그런 다음 네크로솜은 괴사성 세포사를 유발한다.[17]
'''TNFR2 신호 전달'''
TNFR1과 달리 TNFR2는 내피 세포, 섬유아세포, 일부 신경 세포 및 면역 세포를 포함한 제한된 세포 유형에서 발현된다. TNFR2는 막관통 종양괴사인자 알파(tmTNF)에 의해서만 완전히 활성화되는 반면, 가용성 종양괴사인자 알파(sTNF)에 의한 활성화는 부분적으로 억제된다. TNFR1과 달리 TNFR2는 세포 사멸 도메인을 가지고 있지 않으므로 직접적인 세포 사멸을 유도할 수 없다. 따라서 TNFR2 활성화는 대부분 세포 생존으로 이어진다. 세포 생존은 세포 내 조건 및 TNFR1의 신호 전달 과정에 따라 전형적인 NF-κB 활성화를 통한 염증 반응 또는 비전형적인 NF-κB 활성화를 통한 세포 증식으로 이어질 수 있다. TNFR2는 또한 TNFR1의 세포 사멸 검사점을 방해하여 간접적으로 세포 사멸을 유발할 수 있다.[18]
'''비전형적 NF-κB 활성화'''
tmTNF에 결합하면 TNFR2가 삼량체화되고 TRAF2와 TRAF1 또는 TRAF3을 직접 모집한다.[18] TRAF2는 TNFR2 신호 전달 복합체의 중심이며 cIAP1/2를 모집한다.[18] 세포 내에 NIK가 축적되면 TRAF2/3와 cIAP1/2가 비활성 NIK와 복합체를 형성할 수 있다.[18] TRAF2/3가 TNFR2에 결합하면 부착된 NIK가 활성화되어 차례로 IKKα를 활성화한다.[18] 이를 통해 p100과 RelB가 이량체로 처리되어 비전형적인 NF-κB 경로를 활성화하여 세포 증식을 유도한다.[18] p100 및 RelB의 발현은 TNFR1에 의한 전형적인 NF-κB 경로의 활성화에 의해 강화된다.[18] 따라서 TNFR2 비전형적인 NF-κB 활성화는 TNFR1에 의한 전형적인 NF-κB 활성화와 세포 내 NIK의 축적에 의존한다.[18]
'''전형적 NF-κB 활성화'''
TNFR2는 전형적인 NF-κB 경로를 활성화할 수 있지만, 이는 비전형적인 NF-κB 활성화보다 덜 일반적이다.[18] TNFR2가 전형적인 NF-κB 경로를 활성화하는 자세한 내용은 알려져 있지 않다.[18] 아마도 TAK1과 IKK는 TRAF2 / TRAF1/3 / cIAP1/2 신호 전달 복합체에 의해 모집되어 차례로 전형적인 NF-κB 경로를 활성화할 것이다.[18]
'''간접적 세포 사멸 유도'''
TNFR2는 비전형적인 NF-κB 경로의 일부로 cIAP1/2를 분해하여 간접적으로 세포 사멸을 유도할 수 있다.[17] cIAP1/2의 분해는 TNFR1 신호 전달 복합체의 유비퀴틴화에 영향을 미쳐 IKK의 기능을 억제한다. 이는 TNFR1에서 IKK 세포 사멸 검사점을 비활성화하여 세포 사멸을 유도한다.[17]
'''역 신호 전달 (Reverse signaling)'''
tmTNF는 수용체로 작용하여 TNFR1 또는 TNFR2에 결합하면 자체 세포 내에서 경로를 활성화할 수 있다. tmTNF 역 신호전달은 리간드 및 세포 유형에 따라 세포 사멸, 세포 사멸 저항, 염증 또는 염증 저항을 유도할 수 있다.[19]
- '''종양 세포''': B세포 림프종 세포와 같은 종양 세포에서 tmTNF 역 신호전달은 NF-κB 활성을 증가시켜 세포 생존 및 세포 사멸 저항을 향상시키는 것으로 나타났다.[19]
- '''자연 살해 세포''': 자연 살해 세포에서 tmTNF 역 신호전달은 퍼포린, 그랜자임 B, Fas 리간드, 그리고 TNF의 발현을 증가시켜 세포 독성 활성을 증가시킨다.[19]
- '''T 세포''': T 세포에서 tmTNF 역 신호전달에 의한 JNK 경로의 활성화는 세포 주기 억제 및 세포 사멸로 이어질 수 있다.[19]
- '''단핵구''': 단핵구에서 tmTNF는 가용성 TNF/soluble TNF영어(sTNF)에 대한 단핵구의 염증 반응을 매개하는 이중적인 역할을 하는 것으로 나타났다. tmTNF 역 신호전달이 sTNF에 의해 단핵구가 활성화되기 전에 발생하면 sTNF에 대한 단핵구의 염증 반응이 강화된다. tmTNF 역 신호전달이 sTNF에 의해 단핵구가 활성화된 후에 발생하면 염증 반응이 감소한다.[19] 한편, tmTNF 역 신호전달은 내독소에 대한 단핵구의 염증 반응을 감소시킨다. 이러한 효과는 tmTNF가 JNK 및 p38 경로를 활성화하여 TGF-β 생성을 유도하고, 이는 내독소의 신호 전달 경로를 방해하기 때문에 발생한다.[19]
'''면역 반응'''
선천 면역은 침입하는 병원체에 신속하고 비특이적으로 반응하는 면역계의 첫 번째 방어선이다. 이는 병원체 연관 분자 패턴(PAMP), 예: 내독소와 이중 가닥 바이러스 RNA가 면역 세포의 패턴 인식 수용체(PRR)에 결합하여 면역 조절 사이토카인을 분비하게 함으로써 활성화된다.[20] 이러한 사이토카인, 예를 들어 IL-1, IL-6, IL-8 및 TNF는 주로 대식세포 및 수지상 세포와 같이 박테리아를 삼키는 면역 세포에 의해 분비된다. 이들은 주로 백혈구뿐만 아니라 혈관의 내피 세포에 작용하여 초기 염증 반응을 촉진한다.[20]
'''선천 면역 활성화'''
선천 면역은 침입하는 병원체에 신속하고 비특이적으로 반응하는 면역계의 첫 번째 방어선이다. 이는 병원체 연관 분자 패턴(PAMP), 예: 내독소와 이중 가닥 바이러스 RNA가 면역 세포의 패턴 인식 수용체(PRR)에 결합하여 면역 조절 사이토카인을 분비하게 함으로써 활성화된다.[20] 이러한 사이토카인 (예: IL-1, IL-6, IL-8 및 TNF)은 주로 대식세포 및 수지상 세포와 같이 박테리아를 삼키는 면역 세포에 의해 분비된다. 이들은 주로 백혈구뿐만 아니라 혈관의 내피 세포에 작용하여 초기 염증 반응을 촉진한다.[20]
'''급성 염증 조절'''
선천 면역에서, 종양괴사인자 알파(TNF)는 급성 염증을 조절하는 주요 사이토카인이지만, 특히 IL-1과 같은 다른 사이토카인과 많은 기능을 공유한다.[20] TNF는 TNF 수용체에 결합하여 미생물 확산을 방지하기 위해 혈류를 막는 응고를 유도하도록 내피 세포를 자극하고, 백혈구를 유인하는 케모카인을 분비하도록 내피 세포와 대식세포를 자극한다. 또한, IL-1과 같은 다른 사이토카인의 분비를 유도하며, 호중구와 대식세포를 활성화시키고, 간이 C-반응 단백질과 같은 급성기 반응 단백질을 생성하도록 자극한다. 에너지 생산을 위해 근육과 지방의 이화를 유도하며, 섬유증이라고도 하는 흉터 조직 형성을 자극하는 등의 기능을 수행할 수 있다.[20] TNF는 사이토카인의 분비를 유도하는 것 외에도 사이토카인에 의해 유도될 수 있어 염증 신호의 연쇄 반응을 가능하게 한다. 과도한 양의 TNF는 패혈성 쇼크를 유발할 수 있다.[20]
'''염증 신호 전달 경로'''
TNF 기능의 상당 부분은 MAPK 및 NF-κB와 같은 염증 신호 전달 경로를 통해 매개된다. 많은 병원체는 세포를 점유하고 염증 경로를 방해함으로써 면역 반응을 예방하려 한다. 이에 대한 반응으로 TNFR1 신호 전달 경로는 염증 경로의 활동에 의해 억제되는 세포 사멸 경로를 가지고 있다. 세포의 염증 경로가 방해되면 세포 사멸 경로는 억제되지 않아 세포 사멸을 유발한다. 이는 병원체가 세포 내에서 복제되는 것을 방지하고 면역계에 경고한다.[17]
'''발열 유도'''
종양괴사인자 알파(TNF)는 여러 기전을 통해 발열을 유도한다.
TNF는 인터류킨 1(IL-1)이나 인터류킨 6(IL-6)과 같은 발열성 사이토카인의 방출을 유도한다. 또한 PLA2와 같은 다른 매개체를 통해 발열을 유도할 수 있다.
TNF나 다른 발열 유도 매개체는 혈류를 통해 순환하다가 시상하부에 도달하거나, 시상하부 근처의 대식세포나 내피 세포에서 분비되어 시상하부에 작용할 수 있다.
TNF는 미주 신경을 자극하여 노르에피네프린 분비를 유도하고, 이를 통해 발열을 일으킬 수 있다는 연구 결과도 있다.
TNF는 프로스타글란딘 합성을 통해 시상하부의 OVLT과 상호작용하여 체온을 상승시킨다.
'''중추 신경계'''
종양괴사인자(TNF)는 신경계의 다양한 세포, 특히 신경교 세포, 미세아교세포, 별아교세포, 그리고 신경세포에서 발현되며, 항상성을 유지하는 데 중요한 역할을 한다.[22]
'''시냅스 전달 조절'''
종양괴사인자(TNF)는 TNFR1 신호를 통해 신경세포의 AMPA 수용체와 NMDA 수용체의 표면 발현을 증가시켜 시냅스 전달을 강화할 수 있다. TNF는 또한 GABAA 수용체의 표면 발현을 감소시켜 억제성 시냅스의 활성을 감소시킨다.[22] TNF는 또한 흥분성 신경전달물질인 글루탐산과 아교세포에 의해 생성되는 아연 결합 단백질인 S100B의 방출을 조절할 수 있다. TNF에 의한 신경세포의 흥분과 억제의 조절은 TNF가 시냅스 가소성과 소성에 역할을 한다는 것을 나타낸다.[22]
'''희소돌기아교세포 조절'''
TNF는 TNFR2 신호를 통해 보호 수초를 신경 세포 주변에 생성하는 희소돌기아교세포의 증식과 성숙을 촉진한다. 반면에 TNF는 세포가 별아교세포와 접촉할 때 희소돌기아교세포 전구 세포에 세포 독성을 나타낸다.[22]
6. 1. TNFR1 신호 전달
TNFR1은 대부분의 세포 유형에 존재하며 tmTNF와 sTNF에 모두 결합한다. TNFR1은 세포질 꼬리에 사멸 도메인을 포함하고 있어 세포 사멸을 유발할 수 있다.[18] TNFR1 활성화가 세포 생존 또는 세포 사멸을 유발하는지 여부는 단백질 복합체의 형성에 의해 매개된다. 세포 생존으로 이어지는 복합체 I과 세포 사멸로 이어지는 복합체 II가 그것이다. 기본적으로 TNFR1 활성화는 세포 사멸보다는 세포 증식과 염증을 유발한다. 이러한 염증 경로는 세 개의 세포 사멸 검문 지점을 포함하며, 각 검문 지점은 세포 사멸을 방지하는 데 중요하다.[17]
'''복합체 I (세포 생존)'''
TNF에 의해 활성화되면 TNFR1은 삼량체화되어 RIPK1과 TRADD를 모집하여 복합체 I을 형성하고, 이들은 다시 TRAF2, cIAP1 및 cIAP2, LUBAC를 모집한다. cIAP1과 cIAP2는 K63-연결된 유비퀴틴 사슬을 형성하는 유비퀴틴 연결 효소이며, 이는 TAB2 및 TAB3를 통해 TAK1을 모집한다. LUBAC 또한 M1-연결된 유비퀴틴 사슬을 형성하는 유비퀴틴 연결 효소이며, 이는 NEMO를 통해 IKK를 유인한다. TAK1은 MAPK 경로뿐만 아니라 IKK를 활성화하며, IKK는 다시 전형적인 NF-κB 경로를 활성화한다. MAPK 경로와 NF-κB 경로는 핵 내 여러 전사 인자를 활성화하여 세포 생존, 증식 및 염증 반응을 유발한다. 복합체 I은 A20, CYLD, OTULIN과 같은 탈유비퀴틴화 효소에 의해 음성적으로 조절되며, 이는 복합체 I을 불안정하게 만든다.[17]
'''복합체 II (세포 사멸)'''
RIPK1 및/또는 TRADD가 복합체 I에서 분리되어 FADD와 결합하여 카스파제 8을 활성화하면 복합체 II가 형성되어 세포 사멸로 이어진다.[17] 복합체 IIa는 TRADD를 포함하며 RIPK1 없이 카스파제 8을 활성화할 수 있는 반면, 복합체 IIb는 TRADD를 포함하지 않으므로 카스파제 8의 활성화에 RIPK1에 의존한다. 복합체 I의 경로는 복합체 II가 세포 사멸을 유발하는 것을 방지하는 세 개의 검문 지점을 유도한다.[17]
첫 번째 검문 지점에서 IKK는 복합체 I에 부착된 상태에서 인산화를 통해 RIPK1을 비활성화한다. 이는 RIPK1에 의존하는 복합체 IIb를 비활성화한다. IKK는 복합체 I의 유비퀴틴화에 의존하므로, cIAP1/2 및 LUBAC의 억제, RIPK1 유비퀴틴 수용체 부위의 돌연변이, A20 및 OUTLIN의 결핍과 같은 유비퀴틴화에 영향을 미치는 조건은 이 검문 지점을 비활성화할 수 있다. IKK 검문 지점의 비활성화는 복합체 IIb를 활성화하여 아폽토시스 또는 파이롭토시스를 유발한다. IKK 검문 지점의 비활성화는 또한 NF-κB 경로를 제어하는 두 번째 검문 지점을 비활성화하여 복합체 IIa를 간접적으로 활성화할 수도 있다.[17]
두 번째 검문 지점에서 NF-κB 경로는 복합체 IIa에서 카스파제 8의 활성을 억제하는 FLIP과 같은 생존 촉진 유전자의 발현을 촉진한다. 이 검문 지점은 시클로헥시미드와 같은 번역 억제제뿐만 아니라 NF-κB 경로를 제어하는 IKK 복합체의 비활성화에 의해 비활성화될 수 있다. 이 검문 지점의 비활성화는 복합체 IIa를 활성화하여 아폽토시스를 유발한다.[17]
세 번째 검문 지점에서는 비치명적인 카스파제 8이 TNFR1 신호 전달에 의해 활성화되어 복합체 IIb에 결합하여 RIPK1을 절단하여 비활성화한다. 이 형태의 카스파제 8이 세포 사멸을 일으키지 않는 이유는 알려져 있지 않다. 카스파제 8의 비활성화를 통해 이 검문 지점을 비활성화하면 복합체 IIb의 RIPK1이 RIPK3 및 MLKL에 결합하여 복합체 IIc를 형성하며, 이는 네크로솜이라고도 한다. 그런 다음 네크로솜은 괴사성 세포사를 유발한다.[17]
'''세포 사멸 검문 지점'''
TNFR1 활성화는 세포 증식과 염증을 유발하며, 이러한 염증 경로는 세 개의 세포 사멸 검문 지점을 포함한다.[17] 각 검문 지점은 세포 사멸을 방지하는 데 중요한 역할을 한다.
첫 번째 검문 지점에서 IKK는 인산화를 통해 RIPK1을 비활성화한다. 이는 RIPK1에 의존하는 복합체 IIb를 비활성화한다.[17] IKK는 복합체 I의 유비퀴틴화에 의존하므로, cIAP1/2 및 LUBAC의 억제, RIPK1 유비퀴틴 수용체 부위의 돌연변이, A20 및 OUTLIN의 결핍과 같은 유비퀴틴화에 영향을 미치는 조건은 이 검문 지점을 비활성화할 수 있다.[17] IKK 검문 지점의 비활성화는 복합체 IIb를 활성화하여 아폽토시스 또는 파이롭토시스를 유발하며, NF-κB 경로를 제어하는 두 번째 검문 지점을 비활성화하여 복합체 IIa를 간접적으로 활성화할 수도 있다.[17]
두 번째 검문 지점에서 NF-κB 경로는 복합체 IIa에서 카스파제 8의 활성을 억제하는 FLIP과 같은 생존 촉진 유전자의 발현을 촉진한다.[17] 이 검문 지점은 시클로헥시미드와 같은 번역 억제제뿐만 아니라 NF-κB 경로를 제어하는 IKK 복합체의 비활성화에 의해 비활성화될 수 있다.[17] 이 검문 지점의 비활성화는 복합체 IIa를 활성화하여 아폽토시스를 유발한다.[17]
세 번째 검문 지점에서는 비치명적인 카스파제 8이 TNFR1 신호 전달에 의해 활성화되어 복합체 IIb에 결합하여 RIPK1을 절단하여 비활성화한다.[17] 이 형태의 카스파제 8이 세포 사멸을 일으키지 않는 이유는 알려져 있지 않다.[17] 카스파제 8의 비활성화를 통해 이 검문 지점을 비활성화하면 복합체 IIb의 RIPK1이 RIPK3 및 MLKL에 결합하여 복합체 IIc를 형성하며, 이는 네크로솜이라고도 한다.[17] 그런 다음 네크로솜은 괴사성 세포사를 유발한다.[17]
6. 1. 1. 복합체 I (세포 생존)
TNF에 의해 활성화되면 TNFR1은 삼량체화되어 RIPK1과 TRADD를 모집하여 복합체 I을 형성하고, 이들은 다시 TRAF2, cIAP1 및 cIAP2, LUBAC를 모집한다. cIAP1과 cIAP2는 K63-연결된 유비퀴틴 사슬을 형성하는 유비퀴틴 연결 효소이며, 이는 TAB2 및 TAB3를 통해 TAK1을 모집한다. LUBAC 또한 M1-연결된 유비퀴틴 사슬을 형성하는 유비퀴틴 연결 효소이며, 이는 NEMO를 통해 IKK를 유인한다. TAK1은 MAPK 경로뿐만 아니라 IKK를 활성화하며, IKK는 다시 전형적인 NF-κB 경로를 활성화한다. MAPK 경로와 NF-κB 경로는 핵 내 여러 전사 인자를 활성화하여 세포 생존, 증식 및 염증 반응을 유발한다. 복합체 I은 A20, CYLD, OTULIN과 같은 탈유비퀴틴화 효소에 의해 음성적으로 조절되며, 이는 복합체 I을 불안정하게 만든다.[17]
6. 1. 2. 복합체 II (세포 사멸)
RIPK1 및/또는 TRADD가 복합체 I에서 분리되어 FADD와 결합하여 카스파제 8을 활성화하면 복합체 II가 형성되어 세포 사멸로 이어진다.[17] 복합체 IIa는 TRADD를 포함하며 RIPK1 없이 카스파제 8을 활성화할 수 있는 반면, 복합체 IIb는 TRADD를 포함하지 않으므로 카스파제 8의 활성화에 RIPK1에 의존한다.[17] 복합체 I의 경로는 복합체 II가 세포 사멸을 유발하는 것을 방지하는 세 개의 검문 지점을 유도한다.[17]첫 번째 검문 지점에서 IKK는 복합체 I에 부착된 상태에서 인산화를 통해 RIPK1을 비활성화한다. 이는 RIPK1에 의존하는 복합체 IIb를 비활성화한다. IKK는 복합체 I의 유비퀴틴화에 의존하므로, cIAP1/2 및 LUBAC의 억제, RIPK1 유비퀴틴 수용체 부위의 돌연변이, A20 및 OUTLIN의 결핍과 같은 유비퀴틴화에 영향을 미치는 조건은 이 검문 지점을 비활성화할 수 있다. IKK 검문 지점의 비활성화는 복합체 IIb를 활성화하여 아폽토시스 또는 파이롭토시스를 유발한다. IKK 검문 지점의 비활성화는 또한 NF-κB 경로를 제어하는 두 번째 검문 지점을 비활성화하여 복합체 IIa를 간접적으로 활성화할 수도 있다.[17]
두 번째 검문 지점에서 NF-κB 경로는 복합체 IIa에서 카스파제 8의 활성을 억제하는 FLIP과 같은 생존 촉진 유전자의 발현을 촉진한다. 이 검문 지점은 시클로헥시미드와 같은 번역 억제제뿐만 아니라 NF-κB 경로를 제어하는 IKK 복합체의 비활성화에 의해 비활성화될 수 있다. 이 검문 지점의 비활성화는 복합체 IIa를 활성화하여 아폽토시스를 유발한다.[17]
세 번째 검문 지점에서는 비치명적인 카스파제 8이 TNFR1 신호 전달에 의해 활성화되어 복합체 IIb에 결합하여 RIPK1을 절단하여 비활성화한다. 이 형태의 카스파제 8이 세포 사멸을 일으키지 않는 이유는 알려져 있지 않다. 카스파제 8의 비활성화를 통해 이 검문 지점을 비활성화하면 복합체 IIb의 RIPK1이 RIPK3 및 MLKL에 결합하여 복합체 IIc를 형성하며, 이는 네크로솜이라고도 한다. 그런 다음 네크로솜은 괴사성 세포사를 유발한다.[17]
6. 1. 3. 세포 사멸 검문 지점
TNFR1 활성화는 세포 증식과 염증을 유발하며, 이러한 염증 경로는 세 개의 세포 사멸 검문 지점을 포함한다.[17] 각 검문 지점은 세포 사멸을 방지하는 데 중요한 역할을 한다.
첫 번째 검문 지점에서 IKK는 인산화를 통해 RIPK1을 비활성화한다. 이는 RIPK1에 의존하는 복합체 IIb를 비활성화한다.[17] IKK는 복합체 I의 유비퀴틴화에 의존하므로, cIAP1/2 및 LUBAC의 억제, RIPK1 유비퀴틴 수용체 부위의 돌연변이, A20 및 OUTLIN의 결핍과 같은 유비퀴틴화에 영향을 미치는 조건은 이 검문 지점을 비활성화할 수 있다.[17] IKK 검문 지점의 비활성화는 복합체 IIb를 활성화하여 아폽토시스 또는 파이롭토시스를 유발하며, NF-κB 경로를 제어하는 두 번째 검문 지점을 비활성화하여 복합체 IIa를 간접적으로 활성화할 수도 있다.[17]
두 번째 검문 지점에서 NF-κB 경로는 복합체 IIa에서 카스파제 8의 활성을 억제하는 FLIP과 같은 생존 촉진 유전자의 발현을 촉진한다.[17] 이 검문 지점은 시클로헥시미드와 같은 번역 억제제뿐만 아니라 NF-κB 경로를 제어하는 IKK 복합체의 비활성화에 의해 비활성화될 수 있다.[17] 이 검문 지점의 비활성화는 복합체 IIa를 활성화하여 아폽토시스를 유발한다.[17]
세 번째 검문 지점에서는 비치명적인 카스파제 8이 TNFR1 신호 전달에 의해 활성화되어 복합체 IIb에 결합하여 RIPK1을 절단하여 비활성화한다.[17] 이 형태의 카스파제 8이 세포 사멸을 일으키지 않는 이유는 알려져 있지 않다.[17] 카스파제 8의 비활성화를 통해 이 검문 지점을 비활성화하면 복합체 IIb의 RIPK1이 RIPK3 및 MLKL에 결합하여 복합체 IIc를 형성하며, 이는 네크로솜이라고도 한다.[17] 그런 다음 네크로솜은 괴사성 세포사를 유발한다.[17]
6. 2. TNFR2 신호 전달
TNFR1과 달리 TNFR2는 내피 세포, 섬유아세포, 일부 신경 세포 및 면역 세포를 포함한 제한된 세포 유형에서 발현된다. TNFR2는 막관통 종양괴사인자 알파(tmTNF)에 의해서만 완전히 활성화되는 반면, 가용성 종양괴사인자 알파(sTNF)에 의한 활성화는 부분적으로 억제된다. TNFR1과 달리 TNFR2는 세포 사멸 도메인을 가지고 있지 않으므로 직접적인 세포 사멸을 유도할 수 없다. 따라서 TNFR2 활성화는 대부분 세포 생존으로 이어진다. 세포 생존은 세포 내 조건 및 TNFR1의 신호 전달 과정에 따라 전형적인 NF-κB 활성화를 통한 염증 반응 또는 비전형적인 NF-κB 활성화를 통한 세포 증식으로 이어질 수 있다. TNFR2는 또한 TNFR1의 세포 사멸 검사점을 방해하여 간접적으로 세포 사멸을 유발할 수 있다.[18]
tmTNF에 결합하면 TNFR2가 삼량체화되고 TRAF2와 TRAF1 또는 TRAF3을 직접 모집한다. TRAF2는 TNFR2 신호 전달 복합체의 중심이며 cIAP1/2를 모집한다. 세포 내에 NIK가 축적되면 TRAF2/3와 cIAP1/2가 비활성 NIK와 복합체를 형성할 수 있다. TRAF2/3가 TNFR2에 결합하면 부착된 NIK가 활성화되어 차례로 IKKα를 활성화한다. 이를 통해 p100과 RelB가 이량체로 처리되어 비전형적인 NF-κB 경로를 활성화하여 세포 증식을 유도한다. p100 및 RelB의 발현은 TNFR1에 의한 전형적인 NF-κB 경로의 활성화에 의해 강화된다. 따라서 TNFR2 비전형적인 NF-κB 활성화는 TNFR1에 의한 전형적인 NF-κB 활성화와 세포 내 NIK의 축적에 의존한다.[18]
TNFR2는 또한 전형적인 NF-κB 경로를 활성화할 수 있지만, 이는 비전형적인 NF-κB 활성화보다 덜 일반적이다. TNFR2가 전형적인 NF-κB 경로를 활성화하는 자세한 내용은 알려져 있지 않다. 아마도 TAK1과 IKK는 TRAF2 / TRAF1/3 / cIAP1/2 신호 전달 복합체에 의해 모집되어 차례로 전형적인 NF-κB 경로를 활성화할 것이다.[18]
TNFR2는 비전형적인 NF-κB 경로의 일부로 cIAP1/2를 분해하여 간접적으로 세포 사멸을 유도할 수 있다. cIAP1/2의 분해는 TNFR1 신호 전달 복합체의 유비퀴틴화에 영향을 미쳐 IKK의 기능을 억제한다. 이는 TNFR1에서 IKK 세포 사멸 검사점을 비활성화하여 세포 사멸을 유도한다.[17]
6. 2. 1. 비전형적 NF-κB 활성화
tmTNF에 결합하면 TNFR2가 삼량체화되고 TRAF2와 TRAF1 또는 TRAF3을 직접 모집한다.[18] TRAF2는 TNFR2 신호 전달 복합체의 중심이며 cIAP1/2를 모집한다.[18] 세포 내에 NIK가 축적되면 TRAF2/3와 cIAP1/2가 비활성 NIK와 복합체를 형성할 수 있다.[18] TRAF2/3가 TNFR2에 결합하면 부착된 NIK가 활성화되어 차례로 IKKα를 활성화한다.[18] 이를 통해 p100과 RelB가 이량체로 처리되어 비전형적인 NF-κB 경로를 활성화하여 세포 증식을 유도한다.[18] p100 및 RelB의 발현은 TNFR1에 의한 전형적인 NF-κB 경로의 활성화에 의해 강화된다.[18] 따라서 TNFR2 비전형적인 NF-κB 활성화는 TNFR1에 의한 전형적인 NF-κB 활성화와 세포 내 NIK의 축적에 의존한다.[18]
6. 2. 2. 전형적 NF-κB 활성화
TNFR2는 전형적인 NF-κB 경로를 활성화할 수 있지만, 이는 비전형적인 NF-κB 활성화보다 덜 일반적이다.[18] TNFR2가 전형적인 NF-κB 경로를 활성화하는 자세한 내용은 알려져 있지 않다.[18] 아마도 TAK1과 IKK는 TRAF2 / TRAF1/3 / cIAP1/2 신호 전달 복합체에 의해 모집되어 차례로 전형적인 NF-κB 경로를 활성화할 것이다.[18]6. 2. 3. 간접적 세포 사멸 유도
TNFR2는 비전형적인 NF-κB 경로의 일부로 cIAP1/2를 분해하여 간접적으로 세포 사멸을 유도할 수 있다.[17] cIAP1/2의 분해는 TNFR1 신호 전달 복합체의 유비퀴틴화에 영향을 미쳐 IKK의 기능을 억제한다. 이는 TNFR1에서 IKK 세포 사멸 검사점을 비활성화하여 세포 사멸을 유도한다.[17]6. 3. 역 신호 전달 (Reverse signaling)
tmTNF는 수용체로 작용하여 TNFR1 또는 TNFR2에 결합하면 자체 세포 내에서 경로를 활성화할 수 있다. tmTNF 역 신호전달은 리간드 및 세포 유형에 따라 세포 사멸, 세포 사멸 저항, 염증 또는 염증 저항을 유도할 수 있다.[19]B세포 림프종 세포와 같은 종양 세포에서 tmTNF 역 신호전달은 NF-κB 활성을 증가시켜 세포 생존 및 세포 사멸 저항을 향상시키는 것으로 나타났다. 자연 살해 세포에서 tmTNF 역 신호전달은 퍼포린, 그랜자임 B, Fas 리간드, 그리고 TNF의 발현을 증가시켜 세포 독성 활성을 증가시킨다. T 세포에서 tmTNF 역 신호전달에 의한 JNK 경로의 활성화는 세포 주기 억제 및 세포 사멸로 이어질 수 있다.[19]
단핵구에서 tmTNF는 가용성 TNF/soluble TNF영어(sTNF)에 대한 단핵구의 염증 반응을 매개하는 이중적인 역할을 하는 것으로 나타났다. tmTNF 역 신호전달이 sTNF에 의해 단핵구가 활성화되기 전에 발생하면 sTNF에 대한 단핵구의 염증 반응이 강화된다. tmTNF 역 신호전달이 sTNF에 의해 단핵구가 활성화된 후에 발생하면 염증 반응이 감소한다.[19] 한편, tmTNF 역 신호전달은 내독소에 대한 단핵구의 염증 반응을 감소시킨다. 이러한 효과는 tmTNF가 JNK 및 p38 경로를 활성화하여 TGF-β 생성을 유도하고, 이는 내독소의 신호 전달 경로를 방해하기 때문에 발생한다.[19]
6. 3. 1. 종양 세포
tmTNF는 수용체로 작용하여 TNFR1 또는 TNFR2에 결합하면 자체 세포 내에서 경로를 활성화할 수 있다. tmTNF 역 신호전달은 리간드 및 세포 유형에 따라 세포 사멸, 세포 사멸 저항, 염증 또는 염증 저항을 유도할 수 있다.[19]B세포 림프종 세포와 같은 종양 세포에서 tmTNF 역 신호전달은 NF-κB 활성을 증가시켜 세포 생존 및 세포 사멸 저항을 향상시키는 것으로 나타났다.[19]
6. 3. 2. 자연 살해 세포
자연 살해 세포에서 tmTNF 역 신호전달은 퍼포린, 그랜자임 B, Fas 리간드, 그리고 TNF의 발현을 증가시켜 세포 독성 활성을 증가시킨다.[19]6. 3. 3. T 세포
T 세포에서 tmTNF 역 신호전달에 의한 JNK 경로의 활성화는 세포 주기 억제 및 세포 사멸로 이어질 수 있다.[19]6. 3. 4. 단핵구
단핵구에서 tmTNF는 가용성 TNF/soluble TNF영어(sTNF)에 대한 단핵구의 염증 반응을 매개하는 이중적인 역할을 하는 것으로 나타났다. tmTNF 역 신호전달이 sTNF에 의해 단핵구가 활성화되기 전에 발생하면 sTNF에 대한 단핵구의 염증 반응이 강화된다. tmTNF 역 신호전달이 sTNF에 의해 단핵구가 활성화된 후에 발생하면 염증 반응이 감소한다.[19] 한편, tmTNF 역 신호전달은 내독소에 대한 단핵구의 염증 반응을 감소시킨다. 이러한 효과는 tmTNF가 JNK 및 p38 경로를 활성화하여 TGF-β 생성을 유도하고, 이는 내독소의 신호 전달 경로를 방해하기 때문에 발생한다.[19]6. 4. 면역 반응
선천 면역은 침입하는 병원체에 신속하고 비특이적으로 반응하는 면역계의 첫 번째 방어선이다. 이는 병원체 연관 분자 패턴(PAMP), 예: 내독소와 이중 가닥 바이러스 RNA가 면역 세포의 패턴 인식 수용체(PRR)에 결합하여 면역 조절 사이토카인을 분비하게 함으로써 활성화된다.[20] 이러한 사이토카인, 예를 들어 IL-1, IL-6, IL-8 및 TNF는 주로 대식세포 및 수지상 세포와 같이 박테리아를 삼키는 면역 세포에 의해 분비된다. 이들은 주로 백혈구뿐만 아니라 혈관의 내피 세포에 작용하여 초기 염증 반응을 촉진한다.[20]종양괴사인자 알파(TNF)는 급성 염증을 조절하는 주요 사이토카인이지만, 그 기능의 많은 부분이 특히 IL-1과 같은 다른 사이토카인과 공유된다. TNF는 TNF 수용체에 결합하여 미생물의 확산을 방지하기 위해 혈류를 막는 응고를 유도하도록 내피 세포를 자극하고, 백혈구를 유인하는 케모카인을 분비하도록 내피 세포와 대식세포를 자극하며, IL-1과 같은 다른 사이토카인의 분비를 자극하며, 호중구와 대식세포를 활성화시키고, 간이 급성기 반응 단백질, 예: C-반응 단백질을 생성하도록 자극하고, 에너지 생산을 위해 근육과 지방의 이화를 유도하며, 섬유증이라고도 하는 흉터 조직 형성을 자극하는 등의 기능을 수행할 수 있다.[20] TNF는 사이토카인의 분비를 유도하는 것 외에도 사이토카인에 의해 유도될 수 있어 염증 신호의 연쇄 반응을 가능하게 한다. 과도한 양의 TNF는 패혈성 쇼크를 유발할 수 있다.[20]
TNF 기능의 상당 부분은 MAPK 및 NF-κB와 같은 염증 신호 전달 경로를 통해 매개된다. 많은 병원체는 세포를 점유하고 염증 경로를 방해함으로써 면역 반응을 예방하려 한다. 이에 대한 반응으로 TNFR1 신호 전달 경로는 염증 경로의 활동에 의해 억제되는 세포 사멸 경로를 가지고 있다. 세포의 염증 경로가 방해되면 세포 사멸 경로는 억제되지 않아 세포 사멸을 유발한다. 이는 병원체가 세포 내에서 복제되는 것을 방지하고 면역계에 경고한다.[17]
또한, TNF는 신체가 감염과 싸우도록 돕기 위해 발열을 유도한다. TNF는 인터루킨-1 및 인터루킨-6과 같은 사이토카인의 방출을 유발하거나, PLA2와 같은 다른 매개체를 통해 발열을 유발할 수 있다. TNF 또는 그 매개체는 혈류 순환을 통하거나 시상하부 근처의 대식세포 및 내피 세포에 의해 분비됨으로써 시상하부에 도달할 수 있다. TNF는 또한 간의 주요 미주 신경 종말을 자극하여 노르에피네프린을 분비하도록 뉴런에 신호를 보내어 발열을 유도할 수 있다. 이러한 모든 경로는 프로스타글란딘의 합성을 초래하며, 이는 시상하부의 OVLT와 상호 작용하여 신체의 목표 온도를 높인다.[21]
6. 4. 1. 선천 면역 활성화
선천 면역은 침입하는 병원체에 신속하고 비특이적으로 반응하는 면역계의 첫 번째 방어선이다. 이는 병원체 연관 분자 패턴(PAMP), 예: 내독소와 이중 가닥 바이러스 RNA가 면역 세포의 패턴 인식 수용체(PRR)에 결합하여 면역 조절 사이토카인을 분비하게 함으로써 활성화된다.[20] 이러한 사이토카인, 예를 들어 IL-1, IL-6, IL-8 및 TNF는 주로 대식세포 및 수지상 세포와 같이 박테리아를 삼키는 면역 세포에 의해 분비된다. 이들은 주로 백혈구뿐만 아니라 혈관의 내피 세포에 작용하여 초기 염증 반응을 촉진한다.[20]TNF는 급성 염증을 조절하는 주요 사이토카인이지만, 그 기능의 많은 부분이 특히 IL-1과 같은 다른 사이토카인과 공유된다. TNF는 TNF 수용체에 결합하여 미생물의 확산을 방지하기 위해 혈류를 막는 응고를 유도하도록 내피 세포를 자극하고, 백혈구를 유인하는 케모카인을 분비하도록 내피 세포와 대식세포를 자극하며, IL-1과 같은 다른 사이토카인의 분비를 자극하며, 호중구와 대식세포를 활성화시키고, 간이 급성기 반응 단백질, 예: C-반응 단백질을 생성하도록 자극하고, 에너지 생산을 위해 근육과 지방의 이화를 유도하며, 섬유증이라고도 하는 흉터 조직 형성을 자극하는 등의 기능을 수행할 수 있다.[20]
6. 4. 2. 급성 염증 조절
선천 면역에서, 종양괴사인자 알파(TNF)는 급성 염증을 조절하는 주요 사이토카인이지만, 특히 IL-1과 같은 다른 사이토카인과 많은 기능을 공유한다.[20] TNF는 TNF 수용체에 결합하여 미생물 확산을 방지하기 위해 혈류를 막는 응고를 유도하도록 내피 세포를 자극하고, 백혈구를 유인하는 케모카인을 분비하도록 내피 세포와 대식세포를 자극한다. 또한, IL-1과 같은 다른 사이토카인의 분비를 유도하며, 호중구와 대식세포를 활성화시키고, 간이 C-반응 단백질과 같은 급성기 반응 단백질을 생성하도록 자극한다. 에너지 생산을 위해 근육과 지방의 이화를 유도하며, 섬유증이라고도 하는 흉터 조직 형성을 자극하는 등의 기능을 수행할 수 있다.[20] TNF는 사이토카인의 분비를 유도하는 것 외에도 사이토카인에 의해 유도될 수 있어 염증 신호의 연쇄 반응을 가능하게 한다. 과도한 양의 TNF는 패혈성 쇼크를 유발할 수 있다.[20]6. 4. 3. 염증 신호 전달 경로
TNF 기능의 상당 부분은 MAPK 및 NF-κB와 같은 염증 신호 전달 경로를 통해 매개된다. 많은 병원체는 세포를 점유하고 염증 경로를 방해함으로써 면역 반응을 예방하려 한다. 이에 대한 반응으로 TNFR1 신호 전달 경로는 염증 경로의 활동에 의해 억제되는 세포 사멸 경로를 가지고 있다. 세포의 염증 경로가 방해되면 세포 사멸 경로는 억제되지 않아 세포 사멸을 유발한다. 이는 병원체가 세포 내에서 복제되는 것을 방지하고 면역계에 경고한다.[17]6. 4. 4. 발열 유도
종양괴사인자 알파(TNF)는 여러 기전을 통해 발열을 유도한다.TNF는 인터류킨 1(IL-1)이나 인터류킨 6(IL-6)과 같은 발열성 사이토카인의 방출을 유도한다. 또한 포스포리파아제 A2(PLA2)와 같은 다른 매개체를 통해 발열을 유도할 수 있다.
TNF나 다른 발열 유도 매개체는 혈류를 통해 순환하다가 시상하부에 도달하거나, 시상하부 근처의 대식세포나 내피 세포에서 분비되어 시상하부에 작용할 수 있다.
TNF는 미주 신경을 자극하여 노르에피네프린 분비를 유도하고, 이를 통해 발열을 일으킬 수 있다는 연구 결과도 있다.
TNF는 프로스타글란딘 합성을 통해 시상하부의 최종판 혈관 기관(OVLT)과 상호작용하여 체온을 상승시킨다.
6. 5. 중추 신경계
종양괴사인자(TNF)는 신경계의 다양한 세포, 특히 신경교 세포, 미세아교세포, 별아교세포, 그리고 신경세포에서 발현되며, 항상성을 유지하는 데 중요한 역할을 한다.[22]==== 시냅스 전달 조절 ====
종양괴사인자(TNF)는 TNFR1 신호를 통해 신경세포의 AMPA 수용체와 NMDA 수용체의 표면 발현을 증가시켜 시냅스 전달을 강화할 수 있다. TNF는 또한 GABAA 수용체의 표면 발현을 감소시켜 억제성 시냅스의 활성을 감소시킨다.[22] TNF는 또한 흥분성 신경전달물질인 글루탐산과 아교세포에 의해 생성되는 아연 결합 단백질인 S100B의 방출을 조절할 수 있다. TNF에 의한 신경세포의 흥분과 억제의 조절은 TNF가 시냅스 가소성과 소성에 역할을 한다는 것을 나타낸다.[22]
==== 희소돌기아교세포 조절 ====
TNF는 TNFR2 신호를 통해 보호 수초를 신경 세포 주변에 생성하는 희소돌기아교세포의 증식과 성숙을 촉진한다. 반면에 TNF는 세포가 별아교세포와 접촉할 때 희소돌기아교세포 전구 세포에 세포 독성을 나타낸다.[22]
6. 5. 1. 시냅스 전달 조절
종양괴사인자(TNF)는 TNFR1 신호를 통해 신경세포의 AMPA 수용체와 NMDA 수용체의 표면 발현을 증가시켜 시냅스 전달을 강화할 수 있다. TNF는 또한 GABAA 수용체의 표면 발현을 감소시켜 억제성 시냅스의 활성을 감소시킨다.[22] TNF는 또한 흥분성 신경전달물질인 글루탐산과 아교세포에 의해 생성되는 아연 결합 단백질인 S100B의 방출을 조절할 수 있다. TNF에 의한 신경세포의 흥분과 억제의 조절은 TNF가 시냅스 가소성과 소성에 역할을 한다는 것을 나타낸다.[22]6. 5. 2. 희소돌기아교세포 조절
TNF는 TNFR2 신호를 통해 보호 수초를 신경 세포 주변에 생성하는 희소돌기아교세포의 증식과 성숙을 촉진한다. 반면에 TNF는 세포가 별아교세포와 접촉할 때 희소돌기아교세포 전구 세포에 세포 독성을 나타낸다.[22]7. 임상적 의의
7. 1. 자가면역 질환
과도한 TNF 생성은 류마티스 관절염, 염증성 장 질환, 건선성 관절염, 건선, 비감염성 포도막염 등 자가면역 질환의 병리에 핵심적인 역할을 한다.[23] 이러한 질병에서 TNF는 환경적 요인이나 유전자 돌연변이에 대한 반응으로 면역 세포에서 잘못 분비된다. TNF는 이후 염증 반응을 유발하여 정상 조직을 손상시킨다. TNF가 수용체에 결합하는 것을 방지하는 TNF 차단제는 이러한 질병을 치료하는 데 자주 사용된다.[17]TNF는 염증 경로를 활성화하고 세포 사멸을 유발하여 염증을 유도한다. 세포 사멸은 죽어가는 세포의 구성 요소를 인접 세포에 노출시키고, 피부와 장의 장벽 완전성을 손상시켜 미생물이 조직에 침투하도록 하여 염증을 유발한다. TNF는 간섭 사이토카인의 증가, TNFR2 신호 전달의 증가 또는 유전자 돌연변이로 인해 염증성 질환에서 세포 사멸을 유발하는 것으로 여겨진다. RIPK1과 같이 TNF 유도 세포 사멸에 관여하는 단백질을 표적으로 하는 약물은 자가 염증성 질환에 대한 효능을 평가받고 있다.[17]
7. 2. 암
종양괴사인자 알파(TNF)는 처음에는 특히 육종을 죽이는 물질로 발견되었다. 그러나 TNF는 종양 세포에서 증식 또는 사멸을 유도하는 능력 때문에 현재 암에서 촉진제와 억제제 역할을 모두 하는 것으로 알려져 있다. TNF가 암에서 어떤 역할을 하는지 결정하는 정확한 메커니즘은 불분명하다. 일반적으로 TNF는 암 촉진제로 간주된다.[24]일부 암에서 TNF는 주로 국소적으로 반복적으로 고농도로 주사할 때 억제 역할을 하는 것으로 나타났다. TNF의 부작용 때문에 잠재적인 TNF 암 치료법은 전신에 대한 노출을 최소화하면서 종양에 대한 세포 독성을 최대화하는 것을 목표로 한다. 일부 치료법은 TNF로 치료하기 전에 종양의 세포 생존 경로를 억제하여 세포 독성을 증가시킨다. 다른 치료법은 면역세포간질이라고도 알려진 항체-TNF 융합을 사용하여 TNF 활성을 국소화한다. 국소 TNF 치료는 종양의 퇴행을 유도하는 것으로 나타났지만, 완전한 관해를 유도하는 경우는 드물다. 전신적인 TNF 투여는 낮은 효능과 높은 부작용을 보였다.[24]
많은 암에서 TNF는 지원적인 역할을 하는 것으로 여겨진다. 높은 TNF 발현 수준은 더 진행된 암과 관련이 있으며, TNF 발현은 질병의 초기 단계에서 종양 세포에서 발견된다. TNF 발현은 백혈구를 모집하여 전이를 촉진할 수 있으며, 종양 생존, 침윤 및 전이를 촉진하는 경로를 직접 활성화할 수 있다. 인플릭시맙 및 에타너셉트와 같은 TNF 차단제는 대부분의 진행성 또는 전이성 암에서 반응을 유도하지 않았지만, 일부 연구에서는 질병의 안정화를 보였다.[24]
7. 2. 1. 암 억제 역할
종양괴사인자 알파(TNF)는 처음에는 특히 육종을 죽이는 물질로 발견되었다. 그러나 TNF는 종양 세포에서 증식 또는 사멸을 유도하는 능력 때문에 현재 암에서 촉진제와 억제제 역할을 모두 하는 것으로 알려져 있다. TNF가 암에서 어떤 역할을 하는지 결정하는 정확한 메커니즘은 불분명하다. 일반적으로 TNF는 암 촉진제로 간주된다.[24]일부 암에서 TNF는 주로 국소적으로 반복적으로 고농도로 주사할 때 억제 역할을 하는 것으로 나타났다. TNF의 부작용 때문에 잠재적인 TNF 암 치료법은 전신에 대한 노출을 최소화하면서 종양에 대한 세포 독성을 최대화하는 것을 목표로 한다. 일부 치료법은 TNF로 치료하기 전에 종양의 세포 생존 경로를 억제하여 세포 독성을 증가시킨다. 다른 치료법은 면역세포간질이라고도 알려진 항체-TNF 융합을 사용하여 TNF 활성을 국소화한다. 국소 TNF 치료는 종양의 퇴행을 유도하는 것으로 나타났지만, 완전한 관해를 유도하는 경우는 드물다. 전신적인 TNF 투여는 낮은 효능과 높은 부작용을 보였다.[24]
7. 2. 2. 암 촉진 역할
많은 암에서 TNF는 지원적인 역할을 하는 것으로 여겨진다. 높은 TNF 발현 수준은 더 진행된 암과 관련이 있으며, TNF 발현은 질병의 초기 단계에서 종양 세포에서 발견된다.[24] TNF 발현은 백혈구를 모집하여 전이를 촉진할 수 있으며, 종양 생존, 침윤 및 전이를 촉진하는 경로를 직접 활성화할 수 있다.[24] 인플릭시맙 및 에타너셉트와 같은 TNF 차단제는 대부분의 진행성 또는 전이성 암에서 반응을 유도하지 않았지만, 일부 연구에서는 질병의 안정화를 보였다.[24]7. 3. 감염
종양괴사인자 알파(TNF)는 감염에 대한 선천 면역 반응에서 중요한 역할을 한다. 따라서 TNF 차단제의 사용은 바리셀라-조스터 바이러스, 엡스타인-바 바이러스, 거대세포 바이러스와 같은 감염 위험 증가와 관련이 있다.[25]
반대로, TNF는 HIV 감염자의 T 세포의 세포 사멸을 유도하여 HIV의 진행에 역할을 한다. TNF 차단은 감염 악화 없이 HIV의 임상적 개선으로 이어졌다고 보고되었지만, 데이터는 제한적이다.[25]
7. 4. 패혈증
TNF는 선천 면역계와 혈액 응고를 상향 조절하는 능력을 가지기 때문에 패혈증의 중요한 원인으로 여겨진다.[26] 동물에게 TNF를 주입하면 패혈증과 유사한 심장, 폐, 신장, 간 기능 부전을 일으킬 수 있다. 그러나 패혈증으로 고통받는 인간에게서 TNF는 일관되게 상승하지 않는다.[26]TNF 억제제는 쥐의 패혈증 치료에 효과를 보였지만, 인간의 패혈증 치료에는 혼조된 결과를 보였다. 이는 TNF가 면역계에서 하는 이중 역할 때문으로 여겨진다. TNF를 차단하면 패혈증을 유발하는 심각한 염증이 감소하지만, 면역계가 감염에 저항하는 능력도 방해한다. TNF 억제제는 사망 확률이 높은 중증 패혈증의 경우에 더 유익할 것으로 추정된다.[26]
7. 5. 간 섬유화
종양괴사인자 알파(TNF)는 간 손상 및 염증의 핵심적인 역할을 하지만, 간 섬유화에서의 역할은 논란의 여지가 있다. TNF는 간 섬유화의 주요 원인으로 여겨지는 간성상세포(HSC)의 활성화와 생존에 기여한다. 반면에 TNF는 ''시험관 내''에서 알파-1형 콜라겐 발현과 HSC 증식을 억제하여 간 섬유화를 억제하는 작용을 보이기도 한다.[27] 일반적으로 TNF는 HSC 생존을 촉진하여 간 섬유화를 촉진하는 것으로 여겨진다.[27] 이러한 연관성에도 불구하고, TNF 차단제는 간 섬유화 치료에 사용되지 않는다. 알코올성 간염의 임상 시험에서 TNF 차단제는 유의미한 효과를 보이지 않았다.[27]또한, 간 손상과 섬유화를 유발하는 초기 사건인 간세포의 괴사는 TNF에 의해 유도될 수 있지만, 이러한 연관성은 불확실하다. TNF 단독 주입으로는 ''생체 내''에서 간세포 괴사를 유도하지 않는다. 그러나 TNF 주입이 C형 간염 바이러스 감염 시와 같이 생존 경로 억제와 결합될 때, TNF는 간세포 괴사 및 급성 간 부전을 유도한다. 괴사된 간세포의 잔해는 HSC와 쿠퍼 세포에 의해 소비되며, 이들은 이후 TGF-β와 같은 섬유화 촉진 인자를 분비하고 추가적인 간세포 괴사를 촉진한다.[27]
7. 6. 인슐린 저항성
종양괴사인자 (TNF)는 인슐린 수용체 기질 1(IRS1)을 억제하여 인슐린 저항성을 유발한다.[28] 정상적인 상황에서 IRS1은 인슐린에 의해 활성화되면 티로신 인산화를 거쳐 세포 내 포도당 흡수를 증가시킨다.[28] 그러나 TNF가 IRS1의 세린 인산화를 유도하여 IRS1을 인슐린 억제제로 전환하면 이 과정이 방해받는다.[28] TNF에 의해 유도된 인슐린 저항성은 비만에서 흔하게 나타나며, 제2형 당뇨병으로 이어질 수 있다.[28] TNF는 비만이 있는 인간과 동물의 지방 조직에서 상향 조절되는 것으로 밝혀졌지만, 비만이 높은 TNF 수치를 유발하는 이유는 아직 불분명하다.[28]7. 7. 비알코올 지방간 질환 (NAFLD)
종양괴사인자 알파(TNF)는 지방이 간에 축적되어 손상, 염증 및 흉터를 유발하는 비알코올 지방간 질환(NAFLD)에서 중요한 역할을 한다. TNF는 인슐린 저항성을 촉진하여 간에 지방이 축적되도록 한다. 지방이 간과 주변의 지방 조직에 축적됨에 따라 면역 세포가 확장되는 조직에 침투하여 TNF를 분비하여 염증을 유발할 수 있다. 따라서 TNF는 염증, 인슐린 저항성 및 간 내 지방 축적 사이의 인과 관계를 제공할 수 있다. 임상 연구에 따르면 TNF 수치는 NAFLD의 심각성과 상관관계가 있지만, 일부 연구에서는 그렇지 않은 결과를 보이기도 한다. TNF를 하향 조절하는 약리학적 전략은 NAFLD에 긍정적인 영향을 미치는 것으로 나타났지만, TNF 차단제의 효능은 아직 평가되지 않았다.7. 8. 근육 소모
염증을 유발하는 질환(예: 암)은 근육 소모에 기여하는 종양괴사인자 알파(TNF) 수치를 증가시킬 수 있다.[30] TNF는 NF-κB 경로를 활성화하여 단백질을 분해하는 프로테아좀 경로를 활성화하고, 단백질 재생을 담당하는 위성 세포의 활성화를 억제함으로써 근육 소모에 기여한다.[30] 그러나 TNF 차단제는 임상 연구에서 근육 소모에 제한적인 효과를 보였는데, 이는 근육 소모의 다요인적인 특성 때문일 가능성이 높다.[30]7. 9. 운동
운동 중에는 IL-6과 종양 괴사 인자(TNF) 억제제의 수치가 빠르게 증가하여 항염증 효과를 나타낸다.[31] 이어서 IL-10과 가용성 TNF 수용체의 수치가 증가하는데, 이들 모두 TNF를 억제한다.[31] 중간 강도의 운동은 TNF 수치를 증가시키지 않지만, 격렬한 운동은 TNF 수치를 두 배로 증가시켜 염증 촉진 효과를 유발하는 것으로 나타났다.[31] 그러나 이러한 염증 촉진 효과는 IL-6의 항염증 효과에 의해 상쇄되며, IL-6는 50배까지 증가할 수 있다.[31] 규칙적인 운동은 장기적으로 기저 TNF 수치를 감소시키는 것으로 나타났다.[31] 따라서 운동은 일반적으로 TNF를 억제하는 것으로 간주되며, 이는 운동의 전반적인 항염증 효과에 기여한다.[31]7. 10. 신경 염증
중추신경계에서 종양괴사인자 알파(TNF)는 주로 미세아교세포(일종의 대식세포)에서 생성되는데, 뉴런, 내피 세포, 면역 세포에서도 생성된다. 과도한 TNF는 흥분독성 신경 세포 사멸을 유발하고, 글루탐산 수치를 증가시키며, 미세아교세포를 활성화시키고, 혈액뇌장벽을 파괴함으로써 신경 염증에 기여한다. 그 결과, TNF는 신경사르코이드증, 다발성 경화증, 신경 베체트병을 포함한 신경 염증과 관련된 중추 신경계 질환에서 중요한 역할을 하는 것으로 여겨진다.[32]7. 10. 1. 다발성 경화증
종양괴사인자 알파(TNF) 차단제는 뉴런의 탈수초화를 유발하고 다발성 경화증 증상을 악화시킬 수 있다. 이것은 특히 TNFR2를 통한 뉴런 수초 형성에 대한 중추 신경계 내 TNF의 항상성 역할 때문인 것으로 여겨진다.[32] TNFR1의 선택적 차단은 동물 모델에서 긍정적인 결과를 보였다.[32]참조
[1]
논문
Beyond TNF: TNF superfamily cytokines as targets for the treatment of rheumatic diseases
2017-03
[2]
논문
Metabolic Messengers: tumour necrosis factor
2021-10
[3]
논문
Tumor Necrosis Factor and the Tenacious α
2016-05
[4]
논문
Tumor Necrosis Factor Superfamily: Ancestral Functions and Remodeling in Early Vertebrate Evolution
2020-11
[5]
논문
Tumor necrosis factors
2004-05
[6]
논문
Tumor necrosis factor: biology and therapeutic inhibitors
2000-10
[7]
서적
TNF Pathophysiology
Karger
2010
[8]
논문
Human lymphotoxin and tumor necrosis factor genes: structure, homology and chromosomal localization
1985-09
[9]
논문
TNF (tumor necrosis factor (TNF superfamily, member 2))
https://atlasgenetic[...]
2004-06
[10]
논문
Tumor Necrosis Factor-α Signaling in Macrophages
[11]
논문
AU-rich element-mediated translational control: complexity and multiple activities of trans-activating factors
2002-11
[12]
논문
Transmembrane TNF-alpha: structure, function and interaction with anti-TNF agents
2010-07
[13]
논문
Structure of tumour necrosis factor
1989-03
[14]
논문
Therapeutic TNF Inhibitors can Differentially Stabilize Trimeric TNF by Inhibiting Monomer Exchange
2016-09
[15]
논문
Expanding the Concepts in Protein Structure-Function Relationships and Enzyme Kinetics: Teaching using Morpheeins
2013-01
[16]
논문
Impact of quaternary structure dynamics on allosteric drug discovery
2013-01
[17]
논문
Death by TNF: a road to inflammation
2023-05
[18]
논문
Tumor Necrosis Factor Receptors: Pleiotropic Signaling Complexes and Their Differential Effects
2020-11
[19]
논문
Transmembrane TNF-alpha reverse signaling leading to TGF-beta production is selectively activated by TNF targeting molecules: Therapeutic implications
2017-01
[20]
서적
Microbiology
https://bio.libretex[...]
LibreTexts
2013-11-21
[21]
논문
Circulating Cytokines as Mediators of Fever
2000-10
[22]
논문
Role of tumor necrosis factor-alpha in the central nervous system: a focus on autoimmune disorders
2023-07
[23]
논문
The Role of Tumor Necrosis Factor Alpha (TNF-α) in Autoimmune Disease and Current TNF-α Inhibitors in Therapeutics
2021-03
[24]
논문
Tumor Necrosis Factor α: Taking a Personalized Road in Cancer Therapy
2022-05
[25]
논문
Tumor necrosis factor blockade and the risk of viral infection
2010-02
[26]
논문
The evolving experience with therapeutic TNF inhibition in sepsis: considering the potential influence of risk of death
2011-11
[27]
논문
TNFα in liver fibrosis
2015-12
[28]
논문
TNF short-circuits the insulin receptor
https://www.nature.c[...]
2021-06
[29]
논문
The Role of Tumor Necrosis Factor-Alpha in the Pathogenesis and Treatment of Nonalcoholic Fatty Liver Disease
2023-07
[30]
논문
Cytokine Signaling in Skeletal Muscle Wasting
2016-05
[31]
논문
The effect of exercise on cytokines: implications for musculoskeletal health: a narrative review
2022-01
[32]
논문
Role of tumor necrosis factor-alpha in the central nervous system: a focus on autoimmune disorders
2023-07
[33]
논문
Therapeutic Potential of TNF-α Inhibition for Alzheimer's Disease Prevention
2020-11
[34]
논문
Revisiting TNF Receptor-Associated Periodic Syndrome (TRAPS): Current Perspectives
2020-05
[35]
논문
Why illness might leave a bitter taste in the mouth
2015-04
[36]
논문
Role of tumor necrosis factor-alpha in the central nervous system: a focus on autoimmune disorders
2023-07
[37]
논문
Focus on Anti-Tumour Necrosis Factor (TNF)-α-Related Autoimmune Diseases
2023-05
[38]
저널
Tumor necrosis factor-alpha expression in ischemic neurons
https://archive.org/[...]
[39]
저널
A meta-analysis of cytokines in Alzheimer's disease
[40]
저널
The TNF and TNF receptor superfamilies: integrating mammalian biology
[41]
저널
A meta-analysis of cytokines in major depression
[42]
저널
Controversies surrounding the comorbidity of depression and anxiety in inflammatory bowel disease patients: a literature review
[43]
저널
How TNF was recognized as a key mechanism of disease
2007-06
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com



